- No products in the cart.
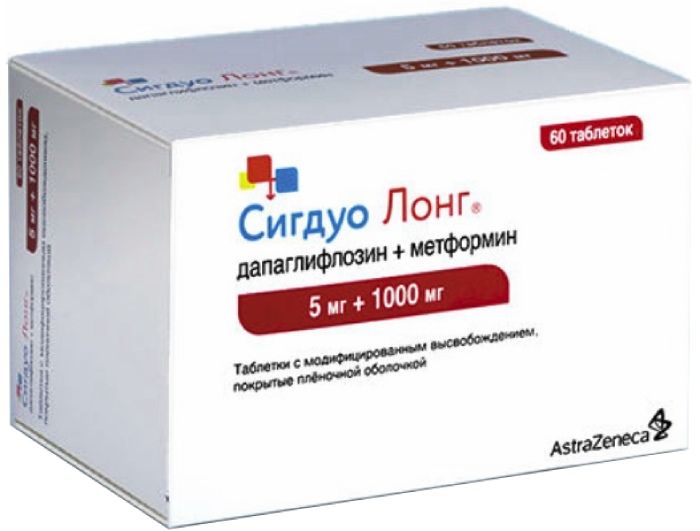
Sigduo Long Table n / a film about modif.vysv. 5mg + 1000mg 60 pieces
$73.40
Sigduo Long Table n / a film about modif.vysv. 5mg + 1000mg 60 pieces
SKU: 897396534 Categories: Diabetes, Hypoglycemic, Medicaments Tags: ASTRAZENECA, dapagliflozin + metformin
Description
Composition
Active substance:
Metformin layer depot –
metformin hydrochloride in a mixture with 0.5% magnesium stearate mg 1005.04 (1000.00 mg metformin hydrochloride + 5.04 mg magnesium stearate)
Layer dapagliflozin –
dapagliflozin propanediol hydrochloride monohydrate 6.15 mg (in terms of dapagliflozin 5 mg)
Excipients:
Metformin layer depot –
carmellose sodium 49.99 mg Hypromellose 2208 234.98 mg Silicon dioxide 13.00 mg magnesium stearate 1.99 mg
Layer dapagliflozin –
microcrystalline cellulose PH302 226,35 mg lactose 48.00 mg Crospovidone 12.00 mg Silicon dioxide 4.50 mg magnesium stearate 3.00 mg
Foil Jacket: Opadray® II pink 85F94592 40,13 mg.
Description:
Oval biconvex tablets covered with a foil cover from pink to dark pink, marked “1071” and “5/1000” on one side.
Product form:
Tablets of 5 mg + 1000 mg:
6 tablets in a blister of aluminum foil.
10 blisters with instructions for use in a cardboard box with a first opening control.
Contraindications
• Individual hypersensitivity to any component of the formulation.
• Type 1 diabetes.
• Renal dysfunction of medium to severe (eGFR
• Hereditary lactose intolerance, lactase deficiency and glucose-galactose intolerance.
• Pregnancy and lactation.
• Children under 18 years of age (safety and efficacy have not been studied).
• Patients taking “loop” diuretics (see. See “The interaction with other drugs”), or with reduced circulating blood volume (CBV), for example because of acute diseases (such as gastrointestinal diseases).
• Elderly patients aged 75 years and older (for the start of therapy dapagliflozin).
• Abnormal liver function.
• Acute diseases, for which there is the risk of renal dysfunction:
dehydration (vomiting, diarrhea), fever, severe infectious disease, condition, hypoxia (shock, sepsis, kidney infection, bronchopulmonary diseases).
• Acute or chronic metabolic acidosis, including diabetic ketoacidosis with or without coma coma. In the case of diabetic ketoacidosis insulin preparations should be used.
• symptomatic manifestations of acute and chronic diseases which may lead to the development of tissue hypoxia (respiratory failure, heart failure, acute myocardial infarction).
• Major surgery and trauma (when carrying insulin shown).
• Chronic alcoholism and acute intoxication with ethanol.
• Lactic acidosis (including history).
• period of at least 48 hours before and 48 hours after the radioisotope or radiological examinations with the introduction of iodinated contrast agents.
• Compliance with hypocaloric diet (
Precautions: urinary tract infection; reduce the risk of BCC; elderly patients; increased the hematocrit value; patients aged over 60 years, performing heavy physical work.
Dosage
5 mg + 1000 mg
Indications
Type 2 diabetes mellitus in addition to diet and exercise to improve glycemic control in adult patients, which is suitable for combination therapy with metformin and dapagliflozin.
Interaction with other drugs
Pharmacokinetic drug interactions studies have not been conducted Sigduo Long®, however, such studies have been conducted for dapagliflozin and metformin, are part of the drug Sigduo Long®.
dapagliflozin
Studies in vitro dapagliflozin and dapagliflozin-3-O-glucuronide not inhibited isozymes of cytochrome P450 CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4 and did not induce isozymes CYP1A2, CYP2B6 and CYP3A4. Dapagliflozin is a weak substrate of P-glycoprotein (P-gp), and dapagliflozin-3-O-glucuronide – active substrate transporter OAT3. Dapagliflozin and dapagliflozin-3-O-glucuronide not significantly inhibit active transporters P-gp, OCT2, OAT1 and OAT3. In general, the effect is not expected dapagliflozin the pharmacokinetics of drugs that are substrates of P-gp, OCT2, OAT1 and OAT3, during their simultaneous use.
The effect of other drugs on dapagliflozin
Interaction studies, mostly with a single dose of the drug showed that metformin, pioglitazone, sitagliptin, glimepiride, voglibose, hydrochlorothiazide, bumetanide, valsartan or simvastatin has no effect on the pharmacokinetics of dapagliflozin.
After the joint application dapagliflozin and rifampicin inductor various active transporters and enzymes involved in drug metabolism, decreased systemic exposure (AUC) 22% dapagliflozin no clinically significant effect on the amount of glucose output by the kidneys during the day. It is not recommended to adjust the dose of the drug.
After the joint application dapagliflozin and mefenamic acid (UGT1A9 inhibitor) was an increase of 51% without systemic exposure dapagliflozin clinically significant effect on the amount of glucose output by the kidneys during the day. It is not recommended to adjust the dose of the drug.
Effect of dapagliflozin other drugs
In studies of interactions in healthy volunteers, mostly, once took a dose of the drug, dapagliflozin did not affect the pharmacokinetic parameters of metformin, pioglitazone, sitagliptin, glimepiride, hydrochlorothiazide, bumetanide, valsartan, simvastatin, warfarin or digoxin. Application of a single dose of 20 mg dapagliflozin and simvastatin resulted in an increase of 19% AUC simvastatin. Increased exposure of simvastatin acid and simvastatinovoy not considered clinically meaningful.
metformin
The effect of other drugs on metformin
Interaction studies with a single dose of drugs have shown that glibenclamide, furosemide, nifedipine, propranolol, ibuprofen, has no effect on the pharmacokinetics of metformin.
Carbonic anhydrase inhibitors: topiramate and other carbonic anhydrase inhibitors (such as zonisamide, acetazolamide or diklofenamid) often cause a decrease in the concentration of bicarbonate in the blood serum and nonanionic interval, hyperchloremic metabolic acidosis. The combined use of these drugs with the drug Sigduo Long® may increase the risk of lactic acidosis. Such patients need more frequent monitoring.
Formulations delaying removal of metformin: concomitant use of drugs that affect renal tubular transport systems involved in the removal of the kidneys metformin (OCT2 inhibitors and MATE, such as ranolazine, vandetanib, dolutegravir and cimetidine), can increase the systemic exposure of metformin and the risk of lactic acidosis. It is necessary to evaluate the potential benefits and possible risks of the joint use of these drugs.
Effect of metformin on other drugs
Interaction studies with a single dose of drugs have shown that metformin has no effect on the pharmacokinetics of glibenclamide, furosemide, nifedipine, propranolol, ibuprofen, and cimetidine.
Medications that can cause hyperglycemia
Taking certain medications, such as diuretics (including thiazide), corticosteroids, phenothiazines, thyroid hormones, estrogen, oral contraceptives, phenytoin, nicotinic acid, sympathomimetics, calcium channel blockers and isoniazid, may predispose to the development of hyperglycemia and impaired glycemic control. If concomitant use of these drugs with the drug Sigduo Long® requires careful monitoring of blood glucose, and at their abolition – observation of the patient because of the possibility of hypoglycemia.
In interaction studies in healthy volunteers at a single dose of drugs were observed interaction of metformin and propranolol, metformin and ibuprofen.
The use of drugs that can cause hypoglycaemia
metformin
Hypoglycemia is not developing in patients taking metformin only in the normal mode, but can occur with a hypocaloric diet, or if the active exercise is not compensated calorie diet, or when combined with other hypoglycemic agents (such as sulfonylureas and insulin) or alcohol. Elderly, debilitated, or malnourished patients, and patients with an inadequate adrenal or pituitary or alcohol intoxication are most susceptible to hypoglycemic effects. Elderly people and patients taking beta-blockers, hypoglycemia diagnosis can be difficult.
Evaluation test 1.5 angidroglyutsitol
dapagliflozin
Patients receiving SGLT2 inhibitors is not recommended to use the test-definition 1.5 angidroglyutsitola for glycemic control. It is necessary to use alternative methods of control.
Estimates of urine analysis results
dapagliflozin
SGLT2 inhibitors increase renal excretion of glucose. Therefore, the results of the determination of glucose in the urine of patients taking the drug Sigduo Long®, will be positive. It is necessary to use alternative methods of control.
Alcohol
Alcohol enhances the effect of metformin on lactate metabolism. Patients should be informed about the inadmissibility of receiving large doses of alcohol during therapy with the drug Sigduo Long®.
Overdose
dapagliflozin
As part of the clinical trial program dapagliflozin cases of overdose have been reported. In case of overdose should be carried out maintenance therapy, given the state of the patient. Derivation of dapagliflozin by hemodialysis has not been studied.
metformin
Cases of overdose of metformin, including when taking more than 50 At around 10% of developing hypoglycemia, but its causal relationship to metformin has not been established. Around 32% of the cases of overdose of metformin lactic acidosis observed in patients. Metformin appears during dialysis, the clearance reaches 170 ml / min. Therefore, when the alleged drug overdose, comprising metformin expedient hemodialysis.
pharmachologic effect
Pharmacological group:
hypoglycemic agent for oral use (an inhibitor of sodium-dependent glucose transporter type 2 + biguanide)
Pharmacological properties:
Mechanism of action
The drug Sigduo Long® combines two antihyperglycemic agents with complementary mechanisms of action to improve glycemic control in patients with type 2 diabetes mellitus (type 2): dapagliflozin, a selective reversible inhibitor of sodium-dependent glucose transporter type 2 (SGLT2), and metformin, a representative of the biguanide class.
Dapagliflozin SGLT2 expressed in renal proximal tubule and is the primary transporter involved in glucose reabsorption. By inhibiting SGLT2, dapagliflozin reduces glucose reabsorption and reduces renal threshold for glucose, which leads to an increase in its excretion by the kidneys.
metformin
Metformin improves glucose tolerance in patients with type 2 diabetes, lowering fasting plasma glucose concentration and postprandial glucose concentration. Metformin decreases hepatic glucose production, reduces glucose absorption in the gut and enhances insulin sensitivity by increasing peripheral glucose uptake and utilization. Metformin does not cause hypoglycemia in patients with type 2 diabetes or healthy people (except in special situations. See section “Special Instructions”) and hyperinsulinemia. During therapy with metformin, insulin secretion remains unchanged, although the concentration of fasting insulin in response to food intake may be reduced during the day.
Pharmacodynamics:
dapagliflozin
Upon receiving dapagliflozin healthy volunteers and patients with type 2 diabetes was observed increase of renal glucose output. When receiving dapagliflozin in a dose of 5 mg per day or 10 mg per day for 12 weeks to patients with type 2 per day excreted by the kidneys approximately 70 g of glucose. When receiving dapagliflozin in a dose of 20 mg daily excretion of glucose substantially becomes maximum. Renal excretion of glucose in the application dapagliflozin also leads to an increase in urine volume (cm. See “Side effect”).
clinical efficacy
Starting combination therapy with metformin, a long-acting
The safety and efficacy of combination therapy starting metformin and dapagliflozin prolonged action were studied in two controlled studies of 24 weeks in patients with type 2 diabetes and inadequate glycemic control with previously untreated hypoglycemic therapy.
Use of metformin dapagliflozin and prolonged action (daily dose of 2 g) provided a significant reduction in the concentration of glycosylated hemoglobin (HbA1c) and concentration in fasting plasma glucose (FPG) compared with monotherapy of metformin or dapagliflozin. Also, the combination therapy dapagliflozin and metformin prolonged action provided a significant reduction in body weight compared to metformin monotherapy prolonged action.
Adding dapagliflozin to metformin conventional release
Safety and efficacy of dapagliflozin addition to the usual release metformin therapy were investigated in a controlled study of 24 weeks in diabetic patients 2 and inadequate glycemic control.
Adding dapagliflozin 10 mg to metformin therapy resulted in a significant decrease in the concentration and HbA1c concentration of FPG, as well as to a decrease in body weight compared to placebo at week 24 of treatment. Also, a statistically significant (p
Adding dapagliflozin or glipizide to metformin conventional release
Safety and efficacy of dapagliflozin addition to the usual release metformin therapy compared with glipizide were investigated in a controlled study lasting 52 weeks in diabetic patients 2 and inadequate glycemic control.
Dapagliflozin not less effective than glipizide, reduced mean value of HbA1c concentration by 52 weeks of treatment. In the group of dapagliflozin it was observed a significant decrease in the mean body weight for 52 weeks of treatment, whereas in the glipizide group there was an increase of this indicator. In dapagliflozin group compared with the group of glipizide was achieved statistically significant (p
Pharmacokinetics:
Preparation Sigduo Long® bioequivalent dapagliflozin (Preparation Forsiga) metformin and prolonged action (Preparation of Long Glyukofazh®) at their joint use in appropriate doses.
Exposure indicators dapagliflozin and metformin prolonged action after dosing Sigduo Long® healthy volunteers were comparable after a standard meal and fasted. In case of ingestion Sigduo Long® after a standard meal was decreased maximum concentrations (Cmax) dapagliflozin 35% increase in the time to achieve it (Tmax) for 1-2 hours as compared to administration of the drug on an empty stomach. This difference is not clinically significant. Food intake did not significantly affect the pharmacokinetic parameters of metformin.
Absorption
dapagliflozin
Upon receiving dapagliflozin inwardly fasted Cmax generally achieved within 2 hours. The values of Cmax and AUC (area under the curve of concentration vs. time) increases proportionally with dose dapagliflozin in the therapeutic dose range. Dapagliflozin absolute bioavailability when administered at a dose of 10 mg of 78%. Food intake has a moderate effect on the pharmacokinetics of dapagliflozin in healthy volunteers. Ingestion of high fat dapagliflozin Cmax decreased by 50%, lengthened Tmax of about 1 hour, but did not affect the AUC compared with the fasting state. These changes are not clinically significant, however dapagliflozin can be taken regardless of the meal.
metformin
After oral administration metformin depot Cmax is reached after 4-8 hours (median of 7 hours). The degree of absorption of metformin tablets prolonged action increases by approximately 50% (estimated from the change in AUC) for receiving at meal time. Eating does not affect the Tmax and Cmax.
Distribution
dapagliflozin
Dapagliflozin approximately 91% is associated with malnutrition. Patients with impaired renal or hepatic function, this figure has not changed.
metformin
Metformin not conducted investigating the distribution depot, but the apparent volume of distribution of metformin after single oral administration of tablets of metformin conventional release in a dose of 850 mg, on average, was 654 ± 358 liters. Metformin slightly bound to plasma proteins. Metformin penetrate into erythrocytes.
Metabolism
dapagliflozin
Dapagliflozin metabolism mainly occurs under the action of the enzyme uridine diphosphate glucuronyl-1A9 (UGT1A9); CYP isoenzymes of cytochrome involved in the metabolism of a person to a lesser extent. Dapagliflozin metabolized form, mainly, inactive metabolite dapagliflozin-3-O-glucuronide. After ingestion of 50 mg dapagliflozin 14C-61% of the dose metabolized in dapagliflozin-3-O-glucuronide.
metformin
Studies with single intravenous administration of the drug to healthy volunteers show that metformin is excreted unchanged by the kidneys, it is not metabolized in the liver (in a human metabolites have been identified) and is output through the intestine. Исследования по изучению метаболизма метформина в таблетках пролонгированного действия не проводились.
breeding
Дапаглифлозин
Дапаглифлозин и его метаболиты выводятся, преимущественно, почками, и только менее 2% выводится в неизмененном виде. После приема 50 мг 14C-дапаглифлозина было обнаружено 96% радиоактивности – 75% в моче и 21% – в фекалиях. Примерно 15% радиоактивности, обнаруженной в фекалиях, приходилось на неизмененный дапаглифлозин. T1/2 (период полувыведения из плазмы) после однократного приема дапаглифлозина в дозе 10 мг составляет примерно 12,9 ч.
metformin
Почечный клиренс примерно в 3,5 раза выше клиренса креатинина (КК), что указывает на то, что канальцевая секреция является основным путем выведения метформина. После приема внутрь примерно 90% абсорбированного препарата выводится почками в течение первых 24 ч, при этом период полувыведения из плазмы равен примерно 6,2 ч. В крови период полувыведения составляет примерно 17,6 ч, следовательно, эритроцитарная масса может быть частью распределения.
Pharmacokinetics in special patient groups
Renal function
Дапаглифлозин
В равновесном состоянии (прием дапаглифлозина 1 раз в сутки в дозе 20 мг в течение 7 дней) у пациентов с СД 2 и нарушением функции почек легкой, средней или тяжелой степени (определяемой по расчетной скорости клубочковой фильтрации (рСКФ)) геометрическая средняя системной экспозиции была на 45%, в 2,04 и 3,03 раза выше, чем у пациентов с СД 2 и нормальной функцией почек, соответственно. Повышение системной экспозиции дапаглифлозина у пациентов с СД 2 и нарушением функции почек не сопровождалось соответствующим увеличением количества глюкозы, выводимой почками в течение суток.
Суточная экскреция глюкозы почками в равновесном состоянии у пациентов с СД 2 и нарушением функции почек легкой, средней или тяжелой степени была, соответственно, на 42%, 80% и 90% ниже, по сравнению с пациентами с СД 2 и нормальной функцией почек. Неизвестно, оказывает ли гемодиализ влияние на экспозицию дапаглифлозина (см. разделы «Способ применения и дозы» и «Особые указания»).
metformin
У пациентов с нарушением функции почек (по результатам измерений КК) период полувыведения метформина из плазмы и крови удлиняется, и почечный клиренс снижается.
Нарушение функции печени
Дапаглифлозин
У пациентов с нарушением функции печени легкой или средней степени тяжести (классы А и В по Чайлд-Пью) средние значения Сmax и AUC дапаглифлозина после однократного приема в дозе 10 мг были, соответственно, на 12% и 36% выше по сравнению с аналогичными показателями у здоровых добровольцев. Данные различия не являются клинически значимыми. У пациентов с нарушением функции печени тяжелой степени (класс С по Чайлд-Пью) средние значения Сmax и AUC дапаглифлозина были на 40% и 67% выше, соответственно, по сравнению со здоровыми добровольцами.
metformin
Фармакокинетические исследования метформина у пациентов с нарушением функции печени не проводились.
Пожилой возраст
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, возраст не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина, поэтому коррекция дозы в зависимости от возраста пациента не требуется.
metformin
Ограниченные данные контролируемых исследований фармакокинетики метформина у здоровых добровольцев пожилого возраста позволяют предположить, что общий плазменный клиренс метформина понижается, период полувыведения увеличивается, а Cmax повышается по сравнению со значениями этих параметров у здоровых добровольцев молодого возраста. По этим данным, изменение параметров фармакокинетики метформина с увеличением возраста, в основном, обусловлено изменением функции почек.
Children
Не проводились исследования фармакокинетики препарата Сигдуо Лонг® у детей (см. раздел «Противопоказания»).
Floor
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, пол не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина, поэтому коррекция дозы в зависимости от пола пациента не рекомендуется.
metformin
Фармакокинетические параметры метформина у здоровых добровольцев и пациентов с СД 2 существенно не различались в зависимости от пола. В контролируемых клинических исследованиях у пациентов с СД 2 гипогликемический эффект метформина у мужчин и женщин был сопоставим.
Расовая и этническая принадлежность
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, клинически значимых различий системной экспозиции у представителей европеоидной, негроидной и монголоидной рас не выявлено; коррекция дозы с учетом расовой принадлежности не требуется.
metformin
Не проводились исследования параметров фармакокинетики метформина в зависимости от расовой принадлежности пациента. В клинических исследованиях у пациентов с СД 2 гипогликемический эффект метформина у представителей европеоидной, негроидной рас и пациентов испанского происхождения был сопоставим.
Масса тела
Дапаглифлозин
По результатам популяционного фармакокинетического анализа, масса тела не оказывает клинически значимого влияния на системную экспозицию дапаглифлозина, поэтому коррекция дозы в зависимости от массы тела пациента не требуется.
Pregnancy and breast-feeding
Применение препарата Сигдуо Лонг®, а также его действующих веществ, дапаглифлозина и метформина, в период беременности не изучено, поэтому препарат противопоказан во время беременности. В случае диагностирования беременности терапия препаратом Сигдуо Лонг® должна быть прекращена.
Неизвестно, проникает ли дапаглифлозин, метформин и/или их метаболиты в грудное молоко человека. Нельзя исключить риск для новорожденных/младенцев. Препарат Сигдуо Лонг® противопоказан в период грудного вскармливания.
Conditions of supply of pharmacies
Prescription.
side effects
Дапаглифлозин и метформин
Оценка безопасности проводилась на основании объединенных данных 8 краткосрочных плацебо-контролируемых исследований, в которых дапаглифлозин применялся в комбинации с метформином (в данной комбинации и в дополнение к другой гипогликемической терапии). В этих исследованиях 983 пациента получали дапаглифлозин в дозе 10 мг один раз в сутки и метформин, и 1185 пациентов получали плацебо и метформин.
Общая частота нежелательных явлений в группе дапаглифлозина в дозе 10 мг и метформина составила 60,3% по сравнению с 58,2% в группе плацебо и метформина. У 4% пациентов в группе дапаглифлозина 10 мг и метформина терапия была отменена из-за нежелательных реакций по сравнению с 3,3% в группе плацебо и метформина. Наиболее частыми нежелательными явлениями, приводившими к отмене терапии и отмеченными, как минимум, у 3 пациентов в группе дапаглифлозина 10 мг и метформина, были нарушение функции почек (0,7%), повышение концентрации креатинина в сыворотке крови (0,2%), уменьшение КК (0,2%) и инфекции мочевыводящих путей (0,2%).
Ниже приведены нежелательные реакции по данным 8 краткосрочных плацебо-контролируемых исследований, вне зависимости от оценки исследователем причинно-следственной связи, которые были отмечены, как минимум, у 2% пациентов, принимавших дапаглифлозин и метформин, и, как минимум, на 1% чаще по сравнению с пациентами, получавшими метформин и плацебо.
Нежелательные реакции в плацебо-контролируемых исследованиях1 (вне зависимости от оценки исследователем причинно-следственной связи), отмеченные с частотой > 2% у пациентов, получавших дапаглифлозин и метформин, и, как минимум, на 1% чаще по сравнению с пациентами, получавшими метформин и плацебо (за исключением гипогликемии)2
Инфекции и инвазии
Генитальные инфекции3 – часто
Инфекции мочевыводящих путей4 – часто
Violations of the kidneys and the urinary tract
Полиурия5 – часто
1 8 плацебо-контролируемых исследований включали 2 исследования стартовой комбинированной терапии с метформином, 2 исследования добавления к терапии метформином, 1 исследование добавления к терапии инсулином, 1 исследование добавления к терапии ситаглиптином и 2 исследования добавления к комбинированной гипогликемической терапии. Приведенные данные относятся к краткосрочной терапии (до 24 недель) независимо от назначения дополнительных гипогликемических средств.
2 См. подраздел «Гипогликемия».
3 Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): вульвовагинальная грибковая инфекция, баланит, вагинальная инфекция, генитальная грибковая инфекция, генитальная инфекция, вульвовагинальный кандидоз, кандидозный баланит, вульвовагинит, генитальный кандидоз, вульвит, баланопостит, генитальная инфекция у мужчин, инфекция мочеполового тракта, абсцесс пениса, инфекция пениса, постит, абсцесс вульвы и бактериальный вагинит.
4 Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): инфекция мочевыводящих путей, цистит, инфекция мочевыводящих путей, вызванная бактериями рода Escherichia, инфекция мочеполового тракта, пиелонефрит, тригонит, уретрит, инфекция почек и простатит.
5 Включает следующие предпочтительные термины (перечислены в порядке убывания частоты): поллакиурия, полиурия и увеличение объема выделяемой мочи.
metformin
В плацебо-контролируемых исследованиях метформина пролонгированного действия в качестве монотерапии диарея и тошнота/рвота отмечались более чем у 5% пациентов и чаще, чем в группе плацебо (диарея у 9,6% и 2,6% пациентов, тошнота/рвота у 6,5% и 1,5% пациентов, соответственно). У 0,6% пациентов, получавших метформин пролонгированного действия, диарея привела к прекращению терапии.
Объединенные данные 12 плацебо-контролируемых исследований дапаглифлозина 5 мг и 10 мг
Дапаглифлозин
В 4 исследованиях дапаглифлозин применялся в качестве монотерапии, а в 8 исследованиях – в качестве дополнения к базовой сахароснижающей терапии или в комбинации с метформином. В этих исследованиях 2338 пациентов получали дапаглифлозин, в среднем, в течение 21 недели. 1393 пациента получали плацебо, 1145 пациентов – дапаглифлозин 5 мг, 1193 пациента – дапаглифлозин 10 мг один раз в сутки.
Объединенные данные 13 плацебо-контролируемых исследований дапаглифлозина 10 мг
Оценка безопасности и переносимости дапаглифлозина 10 мг проводилась на основании объединенных данных 13 плацебо-контролируемых исследований: в 3 исследованиях дапаглифлозин изучался в режиме монотерапии, в 9 исследованиях – в качестве дополнительной терапии к проводимой сахароснижающей терапии, и в 1 исследовании в стартовой комбинации с метформином. В этих исследованиях 2360 пациентов получали дапаглифлозин в дозе 10 мг, в среднем, в течение 22 недель.
Описание отдельных нежелательных реакций
Снижение ОЦК
Дапаглифлозин вызывает осмотический диурез, который может приводить к снижению ОЦК. Нежелательные реакции, связанные со снижением ОЦК (включая сообщения об обезвоживании, гиповолемии, ортостатической гипотензии и артериальной гипотензии), приведены ниже (объединенные данные 12 и 13 краткосрочных плацебо-контролируемых исследований дапаглифлозина) (см. раздел «Особые указания»).
Нежелательные реакции, связанные со снижением ОЦК1, в клинических исследованиях дапаглифлозина
1. Общее количество пациентов N (%):
– Объединенные данные 12 плацебо-контролируемых исследований
Плацебо – N=1393 5 (0,4%)
Дапаглифлозин 5 мг – N=1145 7 (0,6%)
Дапаглифлозин 10 мг – N=1193 9 (0,8%)
– Объединенные данные 13 плацебо-контролируемых исследований
Плацебо – N=2295 17 (0,7%)
Дапаглифлозин 10 мг – N=2360 27 (1,1%)
Подгруппы пациентов n (%)
2. Пациенты, принимающие «петлевые» диуретики – Объединенные данные 12 плацебо-контролируемых исследований
Плацебо – n=55 1 (1,8%)
Дапаглифлозин 5 мг – n=40 0
Дапаглифлозин 10 мг – n=31 3 (9,7%)
– Объединенные данные 13 плацебо-контролируемых исследований
Плацебо – n=267 4 (1,5%)
Дапаглифлозин 10 мг – n=236 6 (2,5%)
3. Пациенты с нарушением функции почек средней тяжести (60>рСКФ>30 мл/мин/1,73 м2)
– Объединенные данные 12 плацебо-контролируемых исследований
Плацебо -n=107 2 (1,9%)
Дапаглифлозин 5 мг – n=107 1 (0,9%)
Дапаглифлозин 10 мг – n=89 1 (1,1%)
– Объединенные данные 13 плацебо-контролируемых исследований
Плацебо -n=268 4 (1,5%)
Дапаглифлозин 10 мг – n=265 5 (1,9%)
4. Пациенты >65 лет – Объединенные данные 12 плацебо-контролируемых исследований
Плацебо -n=276 1 (0,4%)
Дапаглифлозин 5 мг – n=216 1 (0,5%)
Дапаглифлозин 10 мг – n=204 3 (1,5%)
– Объединенные данные 13 плацебо-контролируемых исследований
Плацебо -n=711 6 (0,8%)
Дапаглифлозин 10 мг – n=665 11 (1,7%)
1 Снижение ОЦК включало следующие нежелательные реакции: дегидратация, гиповолемия, ортостатическая гипотензия и артериальная гипотензия.
Renal function
На фоне применения дапаглифлозина отмечалось повышение концентрации креатинина в сыворотке крови и снижение рСКФ. У пациентов с нормальной функцией почек или нарушением функции почек легкой степени при включении в исследование концентрация креатинина и рСКФ возвращались к исходному значению на 24 неделе.
Нежелательные реакции, связанные с нарушением функции почек, включая почечную недостаточность и повышение концентрации креатинина в сыворотке, чаще отмечались у пациентов, принимавших дапаглифлозин (см. ниже). Эти нежелательные реакции чаще отмечались у пациентов пожилого возраста и у пациентов с нарушением функции почек (см. ниже). Стойкое снижение рСКФ наблюдалось у пациентов с нарушением функции почек средней степени тяжести (60>СКФ>30 мл/мин/1,73 м2).
Доля пациентов, как минимум, с одной нежелательной реакцией, связанной с нарушением функции почек
1. Общая популяция. Пациенты (%), как минимум, с одной нежелательной реакцией – Объединенные данные 6 плацебо-контролируемых исследований (до 104 недель)1
Плацебо – n=785 13 (1,7%)
Дапаглифлозин 5 мг – n=767 14 (1,8%)
Дапаглифлозин 10 мг – n=859 16 (1,9%)
– Объединенные данные 9 плацебо-контролируемых исследований (до 104 недель)2
Плацебо – n=1956 82 (4,2%)
Дапаглифлозин 10 мг – n=2026 136 (6,7%)
2. Пациенты >65 лет. Пациенты (%), как минимум, с одной нежелательной реакцией – Объединенные данные 6 плацебо-контролируемых исследований (до 104 недель)1
Плацебо – n=190 4 (2,1%)
Дапаглифлозин 5 мг – n=162 5 (3,1%)
Дапаглифлозин 10 мг – n=159 6 (3,8%)
– Объединенные данные 9 плацебо-контролируемых исследований (до 104 недель)2
Плацебо – n=655 52 (7,9%)
Дапаглифлозин 10 мг – n=620 87 (14,0%)
3. Пациенты с 60>рСКФ>30 мл/мин/1,73 м2. Пациенты (%), как минимум, с одной нежелательной реакцией – Объединенные данные 6 плацебо-контролируемых исследований (до 104 недель)1
Плацебо – n=77 5 (6,5%)
Дапаглифлозин 5 мг – n=88 7 (8,0%))
Дапаглифлозин 10 мг – n=75 9 (12,0%)
– Объединенные данные 9 плацебо-контролируемых исследований (до 104 недель)2
Плацебо – n=249 40 (16,1%)
Дапаглифлозин 10 мг – n=251 71 (28,3%)
4. Пациенты >65 лет с 60>рСКФ>30 мл/мин/1,73 м2/ Пациенты (%), как минимум, с одной нежелательной реакцией – Объединенные данные 6 плацебо-контролируемых исследований (до 104 недель)1
Плацебо – n=41 2 (4,9%)
Дапаглифлозин 5 мг – n=43 3 (7,0%)
Дапаглифлозин 10 мг – n=35 4 (11,4%)
– Объединенные данные 9 плацебо-контролируемых исследований (до 104 недель)2
Плацебо – n=141 27 (19,1%)
Дапаглифлозин 10 мг – n=134 47 (35,1%)
1 Пациенты из 12 плацебо-контролируемых исследований с продленным периодом.
2 Пациенты из 13 плацебо-контролируемых исследований с продленным периодом.
В исследовании с участием пациентов с нарушением функции почек средней степени тяжести (60>рСКФ>30 мл/мин/1,73 м2) продолжительностью до 104 недель у 13 пациентов были отмечены переломы костей (5 случаев в группе дапаглифлозина 5 мг; 8 случаев в группе дапаглифлозина 10 мг; в группе плацебо переломов не зарегистрировано). В 11 из 13 случаев переломы произошли в первые 52 недели леч
Additional information
| Weight | 0.100 kg |
|---|---|
| Manufacturer | ASTRAZENECA |












There are no reviews yet.