- No products in the cart.
Fluconazole-Teva capsules. 50mg 7 pc

EDAS-127 25ml vial, cap. mastiol with mastitis
$6.88
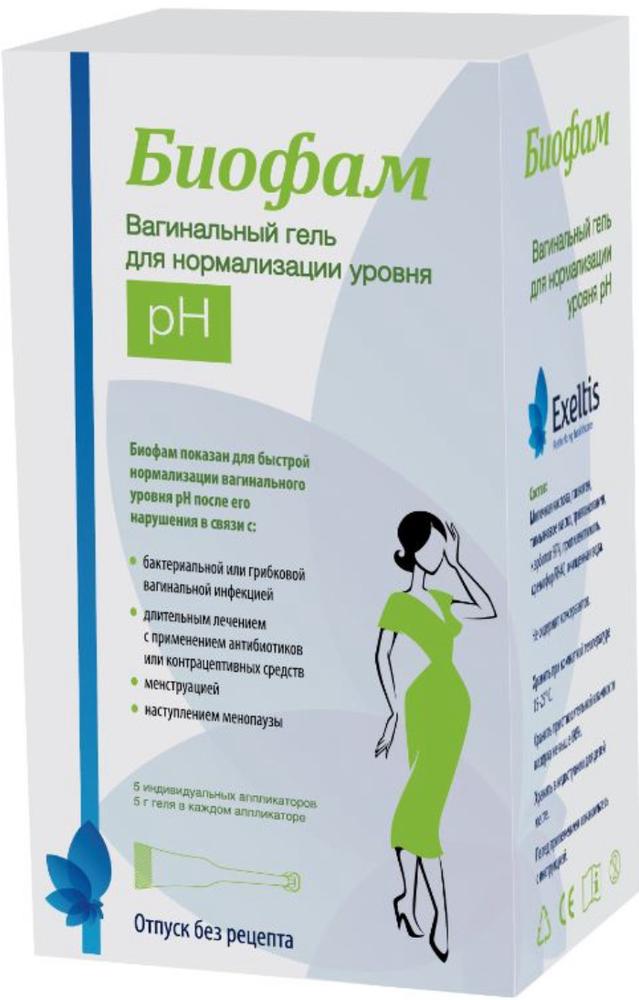
Biofach vaginal gel to normalize the ph level of 5g 5 pcs ind.applikator
$16.50
$7.30
Fluconazole-Teva capsules. 50mg 7 pc
Description
Composition
Active substance:
Fluconazole 50.00 mg
Excipients:
lactose monohydrate 47.00 mg corn starch 16.65 mg Colloidal silicon dioxide 0.1125 mg, 0.1125 mg of sodium lauryl sulfate, magnesium stearate 1.125 mg.
The gelatin capsule body: titanium dioxide (E171) 0.46 m, gelatine q.s. up to 22,8 / q.s, cover.:
titanium dioxide (E171) 0.30 mg, brilliant blue FCF (E133) 0.005 mg gelatine q.s. to 15.2 / q.s.mg.
Description:
hard gelatin capsule with an opaque cover №4 light blue color and the body in white.
Product form:
Capsules, 50 mg.
7 capsules in blisters of aluminum foil / PVC / PVDC; 1 blister with instructions for use in a cardboard bundle from the first control opening.
Contraindications
– Increased sensitivity to fluconazole, other components of the drug substances with or similar to the azole fluconazole-containing chemical structure;
– simultaneous reception of terfenadine during repeated use of fluconazole in a dose of 400 mg / day or more (see “Interaction with other drugs.”);
– simultaneous use with drugs that increase the QT interval and metabolized via SYR3A4 isoenzyme, such as cisapride, astemizole, amiodarone, erythromycin, pimozide and quinidine (see “Interaction with other drugs.”);
– galactose intolerance, lactase deficiency and malabsorption of glucose / galactose;
– Children up to age 3 years (for a given dosage form).
Be wary – Violation of liver function;
– renal dysfunction;
– rash fluconazole against application in patients with superficial fungal infection and invasive / systemic fungal infections;
– simultaneous application of terfenadine and fluconazole less than 400 mg / day;
– potentially proarrhythmic status in patients with multiple risk factors (organic heart disease, electrolyte imbalance and promote the development of such disorders concomitant therapy).
Dosage
50 mg
Indications
Fluconazole is indicated for the treatment of the following diseases in adults:
– cryptococcal meningitis.
– coccidioidomycosis.
– Invasive candidiasis.
– mucous candidiasis, including oropharyngeal candidiasis, esophageal candidiasis, candiduria and chronic mucocutaneous candidiasis.
– Chronic atrophic oral candidiasis (associated with wearing dentures) when compliance with oral hygiene or topical treatment insufficient.
– Vaginal candidiasis, acute or recurrent, when local therapy is not applicable.
– Candidal balanitis when local therapy is not applicable.
– ringworm, including tinea pedis, tinea torso, groin dermatophytosis, pityriasis versicolor and cutaneous candidiasis when systemic treatment is shown.
– dermatophyte nail (onychomycosis) when treatment with other drugs is not acceptable.
Fluconazole is indicated for the prevention of the following diseases in adults:
– Relapse of cryptococcal meningitis in patients with high risk of recurrence.
– Relapse of oropharyngeal candidiasis and esophageal candidiasis in HIV-infected patients with a high risk of relapse.
– To reduce the frequency of relapses of vaginal candidiasis (4 or more episodes a year).
– For the prevention of candidiasis infections in patients with prolonged neutropenia (such as patients with hematological malignancies undergoing chemotherapy or patients undergoing hematopoietic stem cell transplantation.
Fluconazole is indicated for use in children.
Fluconazole is used to treat mucosal candidiasis (oropharyngeal candidiasis and oesophageal candidiasis), invasive candidiasis, cryptococcal meningitis and the prophylaxis of Candida infections in patients with weakened immune systems. Fluconazole can be used as maintenance therapy to prevent relapse of cryptococcal meningitis in children with high risk of recurrence.
Interaction with other drugs
Single or multiple administration of fluconazole at 50 mg did not affect the metabolism of phenazone (antipyrine) during their simultaneous use.
Concomitant use of fluconazole is contraindicated with the following medications:
Cisapride: while applying fluconazole and cisapride possible unwanted reaction from the heart, including flicker / ventricular flutter (torsade de pointes). Fluconazole 200 mg 1 time per day and cisapride at a dose of 20 mg four times a day resulting in a marked increase in plasma concentrations of cisapride and increase QT interval on the electrocardiogram. Simultaneous treatment with fluconazole and cisapride is contraindicated.
Terfenadine: the simultaneous use of azole antifungals and terfenadine may cause serious arrhythmias by increasing intervals la QT. When receiving Fluconazole, 200 mg / day increasing QT interval is not set, but the use of fluconazole in doses of 400 mg / day and above causes a significant increase in the plasma concentration of terfenadine. Simultaneous administration of fluconazole in doses of 400 mg / day or more is contraindicated with terfenadine (see. The section “Contra ‘). Treatment fluconazole at doses less than 400 mg / day in combination with terfenadine should be carefully monitored.
Astemizole: simultaneous application of fluconazole with astemizole or other drugs the metabolism of which the cytochrome P450 system may be accompanied by increased serum concentrations of these agents. Elevated plasma concentrations of astemizole can lead to a lengthening of QT interval, and in some cases to the development of ventricular arrhythmias tachysystolic type “pirouette» (torsade de pointes). The simultaneous use of astemizole and fluconazole contraindicated.
Pimozide despite the fact that no relevant studies conducted in vitro or in vivo, simultaneous use of fluconazole and pimozide can lead to inhibition of pimozide metabolism. In turn, the increase in plasma concentrations of pimozide may lead to QT prolongation, and in some cases, to the development of ventricular tachycardia type “pirouette» (torsade de pointes). Simultaneous application nrotivopokazano fluconazole and pimozide.
Quinidine: despite the fact that no relevant studies conducted in vitro or in vivo, simultaneous use of fluconazole and quinidine can lead to inhibition of quinidine metabolism. In turn, the increase in plasma concentrations of quinidine may lead to QT prolongation, and in some cases, to the development of ventricular tachycardia type “pirouette» (torsade de pointes). The simultaneous use of quinidine and fluconazole contraindicated.
Erythromycin: simultaneous application of erythromycin fluconazole and potentially lead to increased risk of cardiotoxicity (prolongation of the interval QT, ventricular tachycardia type “pirouette» (torsade de pointes)) and, therefore, a sudden cardiac arrest. The simultaneous use of fluconazole and erythromycin contraindicated.
Amiodarone: Fluconazole simultaneous use of amiodarone and may reduce the metabolism of amiodarone and lengthening the interval QT. The simultaneous use of fluconazole and amiodarone contraindicated (see. The section “Contra ‘).
Care should be taken and possibly to adjust the dose, while the application of the following preparations and fluconazole:
Agents acting on the metabolism and the effects of fluconazole:
Hydrochlorothiazide: repeated application of hydrochlorothiazide simultaneously with fluconazole Fluconazole increases the plasma concentration of 40%. The effect of this severity does not require changes in the fluconazole dose regimen in patients receiving concomitant diuretics, but a doctor should take this into account.
Rifampicin: simultaneous application of fluconazole and rifampicin leads to a decrease in AUC and 25% of the length of the half-life of fluconazole by 20%. Patients taking concomitant rifampin, should take into account the feasibility of increasing the dose of fluconazole.
Formulations for action which affects fluconazole:
Fluconazole is a potent inhibitor of cytochrome P450 isoenzyme SYR2S9 and a moderate inhibitor of isozyme SYR3A4. Furthermore, there is a risk of increasing plasma concentration, and other drugs metabolized isoenzymes SYR2S9 and SYR3A4 while reception with fluconazole. In this connection, care should be taken while the application of these drugs, and if necessary such combinations, patients should be under close medical supervision. Note that the inhibitory effect of fluconazole persists for 4-5 days after the drug due to the long half-life.
Alfentanil: marked decrease in clearance and volume of distribution, half-life, increase alfentanil. This may be due to inhibition of isozyme SYRZA4 fluconazole. You may need a dosage adjustment alfentanil.
Amitriptyline, nortriptyline: increase the effect. The concentration of 5-nortriptyline and / or S-amitriptyline may be measured at the start of combination therapy with fluconazole and one week after the start. If necessary, adjust the dose of amitriptyline / nortriptyline.
Amphotericin B: In a study of mice (including immunosuppression) noted the following results: a small additive antifungal effect in systemic infection caused by Candida albicans, no interaction in intracranial infection caused by Cryptococcus neoformans, and antagonism in systemic infection caused by Aspergillus fumigatus. The clinical significance of these results is not clear.
Anticoagulants: like other antifungal agents from the group of azole fluconazole, while the use of warfarin increases the prothrombin time (12%), and therefore the possible bleeding (hematoma, bleeding from the nose and the gastrointestinal tract, hematuria, melena) . In patients receiving coumarin anticoagulants or indanedionovye and fluconazole, it is necessary to constantly monitor the prothrombin time during treatment and within 8 days after the termination of simultaneous application. You should also assess the feasibility of dose adjustment of anticoagulants.
Azithromycin: while applying inward fluconazole in a single dose of 800 mg of azithromycin in a single dose of 1200 mg expressed pharmacokinetic interaction between the two drugs is not established.
Benzodiazepines (short acting) after oral administration of midazolam fluconazole significantly increases the concentration of midazolam and psychomotor effects and this effect is more pronounced after receiving fluconazole inward than when applied intravenously. If necessary, concomitant therapy benzodiazepines, patients taking fluconazole should be observed in order to reduce the respective doses of the benzodiazepine. When simultaneous administration of a single dose of triazolam, fluconazole triazolam AUC increases by approximately 50%, 25-32% for Cmax and T1 / 2 of 25-50% due to inhibition of the metabolism of triazolam. It may need a dose adjustment of triazolam.
Carbamazepine: Fluconazole inhibits the metabolism of carbamazepine and carbamazepine increases serum concentration of 30%. It is necessary to take into account the risk of developing carbamazepine toxicity. It will be appreciated the need carbamazepine dose correction depending on the concentration / effect.
Nevirapine: co-administration of fluconazole and nevirapine increases by about 100% exposure nevirapine compared with controls by the individual application of nevirapine. Because of the risk of increased release of nevirapine by the concomitant use of drugs requires some precautions and careful monitoring of patients.
Calcium channel blockers: some calcium channel antagonists (nifedipine,
isradipine, amlodipine, verapamil and felodipine) are metabolized by isoenzyme SYR3A4. Fluconazole increases the systemic exposure of calcium channel antagonists. Recommended monitoring for side effects.
Cyclosporin: patients with kidney transplant fluconazole 200 mg / day results in a slow increase of the concentration of cyclosporine. However, when multiple dose of fluconazole in a dose of 100 mg / day cyclosporine concentration changes in bone marrow transplant recipients was observed. With simultaneous application of fluconazole and cyclosporine recommended to control the concentration of cyclosporine in the blood.
Cyclophosphamide: the simultaneous use of cyclophosphamide and fluconazole marked increase in serum bilirubin and creatinine concentrations. This combination is permissible in view of the risk of increasing concentrations of bilirubin and creatinine.
Fentanyl: there is a report of one death, possibly due to the simultaneous reception of fentanyl and fluconazole. It is assumed that the violations associated with fentanyl intoxication. It was shown that fluconazole significantly prolongs excretion time fentanyl. Keep in mind that increasing the concentration of fentanyl can lead to inhibition of the respiratory function.
Halofantrine: fluconazole can increase the concentration in plasma halofantrine due to inhibition of isozyme SYR3A4. Concomitant use of fluconazole and halofantrine may increase the risk of cardiotoxicity (prolongation of the interval QT, «torsade de pointes») and, therefore, sudden cardiac arrest. Concomitant use of fluconazole and halofantrine is not recommended.
HMG-CoA reductase inhibitors: the simultaneous use of fluconazole with inhibitors of HMG-CoA reductase isoenzyme metabolizable SYR3A4 (such as atorvastatin and simvastatin) or isoenzyme CYP2D6 (such as fluvastatin), the risk of myopathy and rhabdomyolysis increases. If necessary, concurrent therapy these drugs, patients should be monitored in order to identify the symptoms of myopathy and rhabdomyolysis. It is necessary to control the concentration of CK. In case of a significant increase in the concentration of CK or if diagnosed or is suspected in the development of myopathy or rhabdomyolysis, therapy inhibitors of HMG-CoA reductase inhibitor should be discontinued.
Losartan: Fluconazole Losartan inhibits metabolism to its active metabolite (E3174), which is responsible for most of the effects associated with antagonism of angiotensin II receptors. A regular control of blood pressure.
Methadone: Fluconazole may increase the plasma concentration of methadone. You may need correction of the dose of methadone.
Nonsteroidal anti-inflammatory drugs (NSAIDs): Cmax and AUC increased flurbiprofen and 81%, respectively 23%. Similarly Cmax and AUC pharmacologically active isomer of [S – (+) – ibuprofen] were increased by 15% and 82% respectively, while the application of fluconazole with racemic ibuprofen (400 mg).
With simultaneous use of fluconazole in a dose of 200 mg / day of celecoxib in a dose of 200 mg, Cmax and AUC celecoxib increased by 68% and 134%, respectively. This combination may reduce the dosage of celecoxib twice.
Despite the lack of dedicated research fluconazole may increase systemic exposure to other NSAIDs, metabolizable SYR2S9 isoenzyme (e.g., naproxen, lornoxicam, meloxicam, diclofenac). It may need a dose adjustment of NSAIDs.
With simultaneous use of NSAIDs and fluconazole patients should be under close medical supervision with a view to identifying and monitoring of adverse events and toxicity related to NSAIDs.
Oral contraceptives: the simultaneous use of combined oral contraceptive with fluconazole at 50 mg significant effect on hormone level is not set, whereas a daily intake of 200 mg fluconazole AUC ethinyl estradiol and levonorgestrel are increased by 40% and 24%, respectively, and upon receipt of 300mg fluconazole weekly AUC of norethindrone and ethinyl estradiol increased by 24% and 13% respectively. Thus, repeated use of fluconazole in the indicated doses can hardly exert influence on the effectiveness of combined oral contraceptive.
Phenytoin: simultaneous application of fluconazole and phenytoin can be accompanied by a clinically significant increase in the concentration of phenytoin. If necessary, the simultaneous use of both drugs phenytoin concentration should be monitored and to adjust the dose to provide a therapeutic blood serum concentration.
Prednisone: there is a report about the development of acute failure of the adrenal cortex in a patient after liver transplantation on the face of the three-month course of fluconazole after therapy. Presumably, cessation of therapy with fluconazole resulted in an increase of isoenzyme activity SYR3A4, which led to increased metabolism of prednisone.
Patients receiving the combination therapy with prednisone and fluconazole, should be kept under close medical supervision cases receiving fluconazole to assess the status of the adrenal cortex.
Рифабутин: одновременное применение флуконазола и рифабутина может привести к повышению сывороточных концентраций последнего до 80%. При одновременном применении флуконазола и рифабутина описаны случаи увеита. Больных, одновременно получающих рифабутин и флуконазол, необходимо тщательно наблюдать.
Саквинавир: AUC повышается приблизительно на 50%, Cmax – на 55%, клиренс саквинавира уменьшается приблизительно на 50% в связи с ингибированием печеночного метаболизма изофермента СYР3А4 и ингибированием Р-гликопротеина. Может понадобиться коррекция дозы саквинавира.
Сиролимус: повышение концентрации сиролимуса в плазме крови, предположительно в связи с ингибированием метаболизма сиролимуса через угнетение изофермента СYР3А4 и Р-гликопротеина. Данная комбинация может применяться с соответствующей коррекцией дозы сиролимуса в зависимости от эффекта/концентрации.
Производные сульфонилмочевины: флуконазол при одновременном приеме с производными сульфонилмочевины приводит к увеличению периода полувыведения пероральных препаратов сульфонилмочевины (хлорпропамида, глибенкламида, глипизида и толбутамида). Больным сахарным диабетом можно назначать совместное применение флуконазола и пероральных препаратов сульфонилмочевины, но при этом следует учитывать возможность развития гипогликемии, кроме того, необходим регулярный контроль глюкозы крови и, при необходимости, коррекция дозы препаратов сульфонилмочевины.
Такролимус: одновременное применение флуконазола и такролимуса (внутрь) приводит к повышению сывороточных концентраций последнего в 5 раз за счет ингибирования метаболизма такролимуса, происходящего в кишечнике посредством изофермента CYP3A4.
Значительных изменений фармакокинетики препаратов не отмечено при применении такролимуса внутривенно. Описаны случаи нефротоксичности. Больных, одновременно принимающих такролимус и флуконазол, следует тщательно наблюдать. Дозу такролимуса следует корректировать в зависимости от степени повышения его концентрации в крови.
Теофиллин: при одновременном применении с флуконазолом в дозе 200 мг в течение 14 дней средняя скорость плазменного клиренса теофиллина снижается на 18%. При назначении флуконазола больным, принимающим теофиллин в высоких дозах, или больным с повышенным риском развития токсического действия теофиллина, следует наблюдать за появлением симптомов передозировки теофиллина и, при необходимости, скорректировать терапию соответствующим образом.
Тофацитиниб: экспозиция тофацитиниба увеличивается при его совместном применении с препаратами, которые являются одновременно умеренными ингибиторами изофермента СYР3А4 и мощными ингибиторами изофермента СYР2С19 (например, флуконазол). Возможно, может понадобиться коррекция дозы тофацитиниба.
Алкалоид барвинка: несмотря на отсутствие целенаправленных исследований, предполагается, что флуконазол может увеличивать концентрацию алкалоидов барвинка (например, винкристина и винбластина) в плазме крови и, таким образом, приводить к нейротоксичности, что, возможно, может быть связано с угнетением изофермента СYР3А4.
Витамин А: имеется сообщение об одном случае развития нежелательных реакций со стороны центральной нервной системы (ЦНС) в виде псевдоопухоли мозга при одновременном применении полностью транс-ретиноевой кислоты и флуконазола, которые исчезли после отмены флуконазола. Применение данной комбинации возможно, но следует помнить о возможности возникновения нежелательных реакций со стороны ЦНС.
Зидовудин: при одновременном применении с флуконазолом отмечается повышение Сmax и AUC зидовудина на 84% и 74% соответственно. Данный эффект, вероятно, обусловлен снижением метаболизма последнего до его главного метаболита. До и после терапии с применением флуконазола в дозе 200 мг/сут в течение 15 дней больным СПИДом и ARC (комплекс, связанный со СПИДом) установлено значительное увеличение AUC зидовудина (20%).
При применении ВИЧ-инфицированными пациентами зидовудина в дозе 200 мг каждые 8
часов в течение 7 дней в сочетании с флуконазолом в дозе 400 мг/сут или без него с интервалом в 21 день между двумя схемами, установлено значительное повышение AUC зидовудина (74%) при одновременном применении с флуконазолом. Больных, получающих такую комбинацию, следует наблюдать с целью выявления побочных эффектов зидовудина.
Вориконазол (ингибитор изоферментов СYР2С9, CYP2C19 и СYР3А4): одновременное применение вориконазола (по 400 мг 2 раза в сутки в первый день, затем по 200 мг два раза в сутки в течение 2,5 дней) и флуконазола (400 мг в первый день, затем по 200 мг в сутки в течение 4 дней) приводит к увеличению концентрации и AUC вориконазола на 57% и 79%, соответственно. Было показано, что данный эффект сохраняется при уменьшении дозы и/или уменьшении кратности приема любого из препаратов. Одновременное применение вориконазола и флуконазола не рекомендуется.
Ивакафтор: при одновременном применении с ивакафтором, стимулятором муковисцидозного регулятора трансмембранной проводимости (CFTR), наблюдалось увеличение экспозиции ивакафтора в 3 раза и экспозиции гидроксиметил-ивакафтора (М1) в 1,9 раза.
Пациентам, одновременно принимающим умеренные ингибиторы СYР3А, такие как флуконазол и эритромицин, рекомендуется снижение дозы ивакафтора до 150 мг один раз в сутки.
Исследования взаимодействия пероральных форм флуконазола при его одновременном приеме с пищей, циметидином, антацидами, а также после тотального облучения тела для подготовки к пересадке костного мозга показали, что эти факторы не оказывают клинически значимого влияния на всасывание флуконазола.
Перечисленные взаимодействия установлены при многократном применении флуконазола; взаимодействия с лекарственными средствами в результате однократного приема флуконазола не известны.
Врачам следует учитывать, что взаимодействие с другими лекарственными средствами специально не изучалось, но оно возможно.
Overdose
Имеются сообщения о передозировке флуконазола. В одном случае у 42-летнего больного, инфицированного вирусом иммунодефицита человека, после приема 8200 мг препарата появились галлюцинации и параноидальное поведение. Больной был госпитализирован; его состояние нормализовалось в течение 48 часов.
В случае передозировки адекватный эффект может быть достигнут при симптоматическом лечении (в том числе поддерживающие меры и промывание желудка).
Флуконазол выводится в основном с мочой, поэтому форсированный диурез, вероятно, может ускорить выведение препарата из организма. Сеанс гемодиализа длительностью 3 часа снижает уровень флуконазола в плазме примерно на 50%.
pharmachologic effect
Pharmacological group:
antifungal agent
Pharmacodynamics:
Флуконазол – синтетический противогрибковый препарат (антимикотик) из группы производных триазола, механизм действия которого связан с селективным ингибированием биосинтеза эргостерина, необходимого для образования клеточной мембраны грибов.
Проявляет активность in vitro и при клинических инфекциях в отношении большинства следующих микроорганизмов: Candida albicans, Candida glabrata (штаммы умеренно чувствительны), Candida pararsilosis, Candida tropicalis, Cryptococcus neoformans.
Активен in vitro в отношении следующих микроорганизмов, однако клиническое значение этого эффекта неизвестно: Candida dubliniensis, Candida guilliermodii, Candida kefyr, Candida lusitaniae.
При введении внутрь флуконазол проявляет активность на различных моделях грибковых инфекций у животных: при оппортунистических микозах, в том числе вызванных Candida spp. (включая генерализованный кандидоз у животных с подавленным иммунитетом);Cryptococcus neoformans (включая внутричерепные инфекции); Microsporum spp. и Trychoptyton spp. Установлена также активность препарата на моделях эндемических микозов у животных, включая инфекции, вызванные Blastomyces dermatitides, Coccidioides immitis (включая внутричерепные инфекции), и Histoplasma capsulatum у животных с нормальным и подавленным иммунитетом.
Флуконазол обладает высокой специфичностью в отношении грибковых ферментов, зависимых от цитохрома Р-450. Терапия флуконазолом в дозе 50 мг/сут в течение до 28 дней не влияет на концентрацию тестостерона в плазме крови у мужчин или концентрацию стероидных гормонов у женщин детородного возраста. Флуконазол в дозе 200-400 мг/сут не оказывает клинически значимого влияния на уровни эндогенных стероидов в крови и их реакцию на стимуляцию адренокортикотропного гормона (АКТГ) у здоровых мужчиндобровольцев.
Механизмы развития резистентности к флуконазолу.
Резистентность к флуконазолу может развиться в следующих случаях: при качественном или количественном изменении фермента ланостерил 14-альфа-деметилазы, являющегося мишенью для флуконазола, уменьшении доступа к этому ферменту флуконазола или комбинации этих механизмов.
Точечные мутации в гене ERG11, кодирующем фермент-мишень, приводят к видоизменению мишени и снижению аффинности к химическим соединениям из группы азолов (в том числе производных триазола, к которым относится флуконазол). Увеличение экспрессии гена ERG11 приводит к образованию высоких концентраций фермента-мишени, что создает потребность в увеличении концентрации флуконазола во внутриклеточной жидкости для подавления всех молекул фермента в клетке.
Второй значительный механизм резистентности заключается в активном выведении флуконазола из внутриклеточного пространства за счет активации двух типов транспортеров, участвующих в активном выведении (эффлюксе) препаратов из грибковой клетки. К таким транспортерам относится основной посредник, кодируемый генами MDR (множественной лекарственной устойчивости), и суперсемейство АТФ-связывающих транспортеров, кодируемых генами CDR (генами резистентности грибов Candida к азоловым антимикотикам).
Гиперэкспрессия гена MDR приводит к резистентности к флуконазолу, в то же время гиперэкспрессия генов CDR может приводить к резистентности к различным азолам.
Резистентность к Candida glabrata обычно опосредована гиперэкспрессией гена CDR, что приводит к резистентности ко многим антимикотикам из группы азолов. Для тех штаммов грибов, для которых минимальная ингибирующая концентрация (МИК) определяется как промежуточная (16-32 мкг/мл), рекомендуется применять максимальные дозы флуконазола.
Candida krusei следует рассматривать как резистентную к флуконазолу. Механизм резистентности связан со сниженной чувствительностью его фермента-мишени к ингибирующему воздействию флуконазола.
Pharmacokinetics:
Фармакокинетика флуконазола при приеме внутрь сходна с фармакокинетикой при внутривенном (в/в) введении.
Suction.
После приема внутрь флуконазол хорошо абсорбируется, его концентрация в плазме крови (и общая биодоступность) превышает 90% концентрации флуконазола в плазме крови после в/в введения. Одновременный прием пищи не влияет на абсорбцию препарата при приеме внутрь. Максимальная концентрация (Cmax) достигается через 0,5-1,5 ч после приема флуконазола натощак. Концентрация в плазме крови пропорциональна дозе. При приеме рекомендуемой суточной дозы 1 раз в день равновесная концентрация (Css) достигает 90% к 4-5-му дню лечения препаратом. Введение в 1-й день ударной дозы, в 2 раза превышающей среднюю суточную дозу, позволяет ускорить достижение Css, равной 90%, ко 2-му дню.
Distribution.
Кажущийся объем распределения приближается к общему содержанию воды в организме. Связывание с белками крови относительно низкое (11-12%).
Флуконазол хорошо проникает во многие жидкости организма. Концентрация флуконазола в слюне, мокроте, грудном молоке, суставной жидкости и перитонеальной жидкости сходна с его концентрацией в плазме крови. Постоянные значения концентрации препарата в вагинальном секрете достигаются через 8 ч после приема внутрь и удерживаются на этом уровне не менее 24 ч. У пациентов с грибковым менингитом концентрация флуконазола в спинномозговой жидкости составляет около 80% от его концентрации в плазме крови. В роговом слое эпидермиса, эпидермисе-дерме и потовой жидкости достигаются высокие концентрации препарата, которые превышают сывороточные. Флуконазол накапливается в роговом слое эпидермиса. При приеме в дозе 50 мг 1 раз/сут концентрация флуконазола в этом слое кожи через 12 дней составляла 73 мкг/г, а через 7 дней после прекращения лечения – 5,8 мкг/г. При применении в дозе 150 мг 1 раз/нед концентрация флуконазола в роговом слое кожи на 7-й день составляла 23,4 мкг/г, а через 7 дней после приема второй дозы – 7,1 мкг/г. Концентрация флуконазола в ногтевых пластинах после 4- месячного применения в дозе 150 мг 1 раз/нед составила 4,05 мкг/г в здоровых и 1,8 мкг/г в пораженных ногтях; через 6 месяцев после завершения терапии флуконазол попрежнему определялся в ногтевых пластинах.
Metabolism and excretion.
Флуконазол выводится в основном почками; примерно 80% введенной дозы обнаруживают в моче в неизмененном виде. Клиренс флуконазола пропорционален клиренсу креатинина. Метаболиты препарата в крови не обнаружены. Длительный период полувыведения (T1/2) из плазмы позволяет принимать флуконазол однократно при вагинальном кандидозе и 1 раз/сут или 1 раз/нед при других показаниях.
Фармакокинетика у детей
У детей были получены следующие значения фармакокинетических параметров:
9 мес-13 лет:
– Однократно – внутрь 2 мг/кг – Период полувыведения (час) – 25,0
– Площадь под кривой «концентрация-время» (AUC) (мкг·ч/мл) – 94,7
9 мес-13 лет:
– Однократно – внутрь 8 мг/кг – Период полувыведения (час) – 19,5
– Площадь под кривой «концентрация-время» (AUC) (мкг·ч/мл) – 362,5
Средний возраст 7 лет:
– Многократно – внутрь 3мг/кг – Период полувыведения (час) – 15,5
– Площадь под кривой «концентрация-время» (AUC) (мкг·ч/мл) – 46,1
Фармакокинетика у пожилых пациентов
Было установлено, что при однократном применении флуконазола в дозе 50 мг внутрь у пожилых пациентов в возрасте 65 лет и старше, некоторые из которых одновременно принимали диуретики, Cmax достигалась через 1,3 часа после приема и составляла 1,54 мкг/мл, средние значения AUC – 76,4 ± 20,3 мкг·ч/мл, а средний период полувыведения – 46,2 часа.
Значения этих фармакокинетических параметров выше, чем у молодых пациентов, что, вероятно, связано с пониженной почечной функцией, характерной для пожилого возраста.
Одновременный прием диуретиков не вызывал выраженного изменения AUC и Cmax.
Клиренс креатинина (74 мл/мин), процент флуконазола, выводимого почками в неизменном виде (0-24 часа, 22%), и почечный клиренс флуконазола (0,124 мл/мин/кг) у пожилых пациентов ниже по сравнению с молодыми пациентами.
Pregnancy and breast-feeding
Адекватных и контролируемых исследований применения флуконазола у беременных женщин не проводилось.
Во время беременности применения флуконазола следует избегать, за исключением случаев тяжелых и потенциально угрожающих жизни грибковых инфекций, когда ожидаемая польза лечения для матери превышает возможный риск для плода.
Необходимо рассмотреть эффективные методы контрацепции у женщин детородного возраста в течение всего периода лечения и приблизительно в течение недели (5-6 периодов полувыведения) после принятия последней дозы препарата (см. раздел «Фармакокинетика»).
Сообщалось о случаях самопроизвольного аборта и развития врожденных аномалий у младенцев, матери которых применяли флуконазол в дозе 150 мг однократно или повторно в первом триместре беременности. Описаны случаи множественных врожденных пороков у новорожденных, матери которых на протяжении большей части или всего первого триместра получали терапию флуконазолом в высокой дозе (400-800 мг/сутки). Были отмечены следующие нарушения развития: брахицефалия, нарушение развития лицевой части черепа, нарушение формирования свода черепа, волчья пасть, искривление бедренных костей, истончение и удлинение ребер, артрогрипоз и врожденные пороки сердца.
Флуконазол обнаруживается в грудном молоке в концентрациях, близких к плазменным, поэтому его применение у женщин в период грудного вскармливания не рекомендуется.
Условия отпус
Additional information
| Weight | 0.100 kg |
|---|---|
| Manufacturer | TEVA |









There are no reviews yet.